Roulement de tambours…
Il s’agit de l’Optogénétique selon le journal scientifique Nature Methods. Et le moins qu’on puisse dire, c’est qu’ils se sont pas fourrés le doigt dans l’œil en la choisissant! Ils se sont même démerdés pour nous concocter une superbe vidéo, simple à comprendre, efficace et impressionnante mais sans tomber dans le sensationnel, bref, un bijou de pédagogie:
Transcription:
Des chercheurs peuvent activer des cellules dans le cerveau de cette souris, simplement en allumant la lumière. La lumière active des cellules du cerveau qui font que l’animal tourne en rond. Ce sympathique tour de magie représente également un outil scientifique important. Utiliser la lumière pour comprendre le comportement cellulaire nous renseigne sur de très nombreuses questions, sur la manière dont on se réveille ou encore notre capacité à apprendre.
Ceci est l’optogénétique.
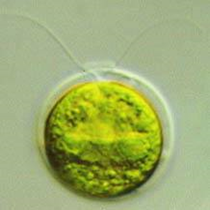
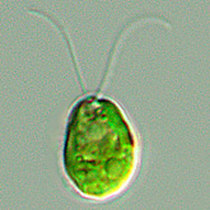
Tout a commencé avec des algues.
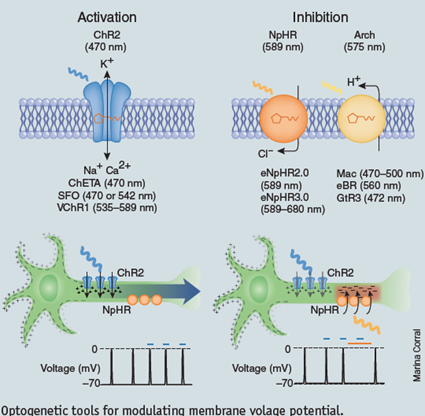
En 2002, des chercheurs ont découvert que la protéine responsable du comportement des algues verte consistant à se rapprocher ou s’éloigner de la lumière, est un canal sensible à la lumière. La lumière bleue oblige le canal à s’ouvrir, et des ions positifs peuvent ainsi rentrer à l’intérieur de la cellule, à l’instar du flux d’ions positifs qui entraine l’activité d’une cellule nerveuse.
De nombreux scientifiques comprirent vite le potentiel de ces algo-protéines. Ils réalisèrent que s’ils étaient capables de faire fonctionner ces canaux de type rhodopsin dans des cellules nerveuse de mammifères, ils auraient une manière de contrôler très précisément l’activité de ces cellules dans le cerveau. Dans de nombreuses applications, cette méthode serait plus efficace que des drogues qui fonctionnent plus lentement, et plus efficace que des stimulations électriques sur le cerveau, qui sont moins précises.
Faire rentrer une protéine d’algue dans un cerveau de souris, par exemple, requiert un peu d’ingénierie génétique. D’abord, on prélève le gène codant pour la protéine, mais également un autre morceau d’ADN appelé promoteur, et on les injecte dans un virus. Quand le virus est introduit dans le cerveau de la souris, il infecte des neurones et introduit le gène. Un sous-ensemble pré-déterminé de neurones aura la machinerie protéique nécessaire à l’activation du promoteur. Et alors uniquement dans ces cellules, la protéine d’algue sera exprimé et le canal inséré dans leur membrane. Pour activer la protéine, tout ce qu’il faut c’est de la lumière qui sera acheminée par un câble de fibre optique.
C’est la possibilité de cibler des neurones spécifiques dans un animal vivant qui rend cette technique si puissante. Et les canaux-rhodopsin ne sont pas les seules protéines qui existent dans la boite à outil de l’optogénétique.
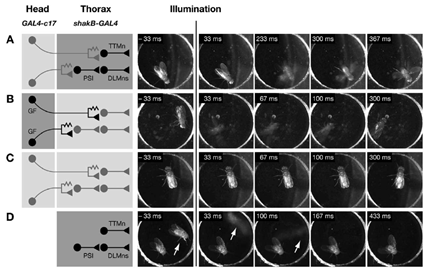
Chez cette mouche, un système différent de protéines sensibles à la lumière est utilisé pour cibler seulement deux neurones parmi 200 000! Ces 2 neurones gouvernent le comportement de fuite: le réflexe qui fait que la mouche fuit quand vous essayez de l’écraser. Ici, c’est un flash de lumière qui active ces neurones, ce qui fait bondir la mouche et étendre ses ailes. Elle ne peut pas s’envoler parce qu’elle ait enfermée dans une boite de Pétri. (Voici ici toutes les autres vidéos publiées dans Cell)
Tout autant qu’ils voulaient activer des neurones, avec de la lumière, les chercheurs voulaient également les inhiber. Désactiver un neurone ne nécessite que l’emploi d’un autre type de protéine sensible à la lumière, comme l’Halo-rhodopsin, et un lumière d’une autre couleur.
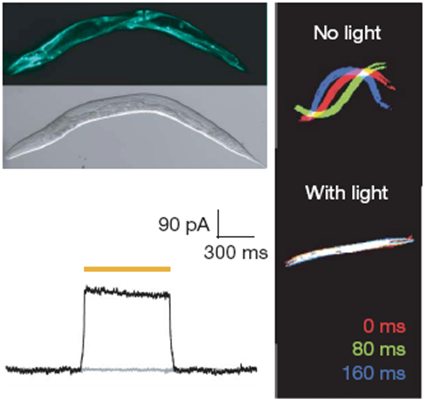
Regardez comment la gymnastique de ce ver est interrompue quand une lumière jaune est allumée. La lumière active l’Halo-rhodopsin, entrainant un flux d’ions négatifs qui inhibe les moto-neurones du ver, et l’empêche de nager (tous les films des différentes expériences tentées sur le nématode C. elegans, ici)
Et les chercheurs en neuroscience ne sont pas les seuls à utiliser l’optogénétique. On peut tout autant utiliser cette technique pour activer et désactiver des neurones, que pour contrôler d’autres processus dans des animaux vivants, mais aussi dans des cultures cellulaires.
Ces cellules de cœur de souris ont été conçues pour battre au rythme de flashs de lumière.
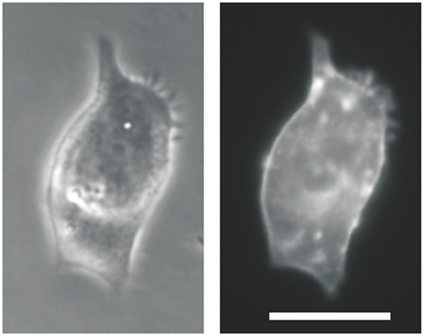
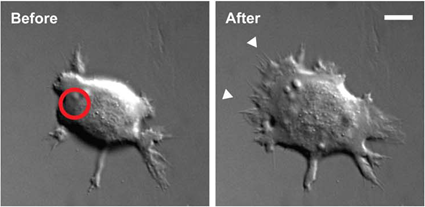
Et ici, une protéine sensible à la lumière fait que cette cellule de peau suit le laser.
Les applications sont infinies. Des chercheurs ont déjà utilisé la lumière pour transformer la marche tremblante de rats atteints de Parkinson, en course assurée, et ont montré quels sont les neurones activés au moment où une souris se réveille.
L’optogénétique jette une lumière dans tous les domaines, du comportement animal jusqu’aux interactions de protéines à l’intérieur de cellules.
C’est pourquoi Nature Methods a sélectionné l’Optogénétique comme méthode de l’année 2010.
Liens:
Références:
Nagel G, Ollig D, Fuhrmann M, Kateriya S, Musti AM, Bamberg E, Hegemann P: Channelrhodopsin-1: a light-gated proton channel in green algae. Science 2002, 296:2395-2398.
Berthold P, Tsunoda SP, Ernst OP, Mages W, Gradmann D, Hegemann P: Channelrhodopsin-1 initiates phototaxis and photophobic responses in chlamydomonas by immediate light-induced depolarization. Plant Cell 2008, 20:1665-1677.
Zhang F, Gradinaru V, Adamantidis AR, Durand R, Airan RD, de Lecea L, Deisseroth K: Optogenetic interrogation of neural circuits: technology for probing mammalian brain structures. Nat Protoc 2010, 5:439-456.
Gradinaru V, Thompson KR, Zhang F, Mogri M, Kay K, Schneider MB, Deisseroth K. Targeting and readout strategies for fast optical neural control in vitro and in vivo. J Neurosci. 2007 Dec 26;27(52):14231-8. [ PDF | Cover Image | Thy-1::ChR2-EYFP Mouse | Wildtype Mouse Control]
Lima SQ, Miesenbock G: Remote control of behavior through genetically targeted photostimulation of neurons. Cell 2005, 121:141-152.
Zhang F, Wang LP, Brauner M, Liewald JF, Kay K, Watzke N, Wood PH, Bamberg E, Nagel G, Gottschalk A, Deisseroth K. Multimodal fast optical interrogation of neural circuitry. Nature. 2007 Apr 5;446:633-39. [ PDF | N&V | 2007 Highlight ]
Bruegmann T, Malan D, Hesse M, Beiert T, Fuegemann CJ, Fleischmann BK, Sasse P: Optogenetic control of heart muscle in vitro and in vivo. Nat Methods 2010, 7:897-900.
Wu YI, Frey D, Lungu OI, Jaehrig A, Schlichting I, Kuhlman B, Hahn KM: A genetically encoded photoactivatable Rac controls the motility of living cells. Nature 2009, 461:104-108.













1 De H - 10/01/2011, 11:26
Comprends pas, comment il font pour le vecteur n’infecte que des neurones déterminés ?
2 De H - 10/01/2011, 11:28
Ou plutôt, pour que le gène ne soit activable que dans des neurones déterminés ?
3 De Vran - 10/01/2011, 12:43
Sans avoir lu les articles en détail, classiquement c'est le promoteur fusionné à la construction ADN qui détermine dans quelle cellules et avec quelle intensité le gène est exprimé. Toutes les cellules pourront être infectées par le virus et intégrer la construction à leur génome, mais seules celles possédant les outils capables de reconnaitre le promoteur pourront l'exprimer.
4 De Taupo - 10/01/2011, 14:02
@H : d'instinct, je dirais que Vran a la bonne réponse... mais moi non plus j'ai pas fait mes devoirs. L'article en question est consultable en référence (targeting and readout strategies for fast optical neural control in vitro and in vivo). Bonne lecture!
5 De Saxifrage Clayborne - 10/01/2011, 14:53
Bonjour,
Je n'ai pas lu l'article non plus, et de plus je n'en suis qu'à mes débuts en génétique, mais je ne comprends pas comment un promoteur pourrait être suffisamment spécifique pour n'activer que "deux neurones parmi 200 000" ?
Dans la vidéo, à 2 minutes 12 secondes, on voit l'appareil qu'ils leur mettent dans le crane, avec plein de petites broches qui en sortent. Est ce que ça ne pourrait pas être des fibres optiques qui guident la lumière vers les neurones visés ?
6 De H - 10/01/2011, 17:08
Oui, voilà, comme Saxifrage. Je m’étais fait intérieurement la réponse qu’a fait Vran, mais je veux bien que ça permette d’être spécifique à un tissu, mais être spécifique au neurone près ça paraît étonnant non ?
7 De Taupo - 10/01/2011, 19:23
@Saxifrage Clayborne : Oui et non. La fibre optique est utilisée pour acheminer la lumière à travers le cerveau pour activer spécifiquement les neurones (même si ils en illuminent plusieurs milliers certainement). Si les neurones ciblés sont au fin fond des méandres du cerveau, il faut que la lumière puisse y pénétrer, d'où l'ustensile utilisé (le cerveau est plutôt opaque). La spécificité de l'expression transgénique, elle, est assurée par un promoteur spécifiquement interprétable dans un sous-ensemble de neurones du cerveau. Tous les neurones seront donc transgéniques, mais seuls les neurones excitatoires pourront interpréter le promoteur CaMKIIalpha qui leur est spécifique.
Ref: Tighilet B, Huntsman M M, Hashikawa T, Murray K D, Isackson P J and Jones E G 1998 Cell-specific expression of type II calcium/calmodulin-dependent protein kinase isoforms and glutamate receptors in normal and visually deprived lateral geniculate nucleus of monkeys J. Comp. Neurol. 390 278–96
Aravanis AM, Wang LP, Zhang F, Meltzer LA, Mogri MZ, Schneider MB, Deisseroth K (2007) An optical neural interface: in vivo control of rodent motor cortex with integrated
fiberoptic and optogenetic technology. J Neural Eng 4:S143–156.
8 De Vran - 10/01/2011, 19:51
Pour ce qui est des 2 neurones parmi 200.000, il faut garder en tête qu'il s'agit d'une drosophile, organisme pour lequel la (quasi) totalité des neurones ont été répertoriés, nommés et identifiés en fonction des gènes qu'ils expriment. Il n'est pas improbable de trouver un gène exprimé par seulement deux neurones par segment ou hémi-segment (la mouche est un animal segmenté et sa larve ressemble à un petit vers annelé) et de réaliser une construction génétique à partir du promoteur de ce gène. Ensuite, il suffit d'introduire la fibre optique dans un seul des segments et de bien viser pour n'exciter que les deux cellules concernées.
9 De Taupo - 10/01/2011, 20:44
@Vran : @Saxifrage Clayborne : En fait, les chercheurs chez la drosophile ont utilisé une lignée de mouches permettant l'expression de n'importe quel transgène uniquement dans deux neurones (la lignée GAL4-c17). Ensuite, pour cette organisme, une illumination diffuse du laser à une longueur d'onde donnée suffit à photo-activer les neurones. (Là où chez la souris, il faut chercher le neurone via la fibre optique).
Ref: Lima SQ, Miesenbock G: Remote control of behavior through genetically targeted photostimulation of neurons. Cell 2005, 121:141-152.
10 De H - 10/01/2011, 21:06
La (quasi) totalité des neurones de la droso ont été répertoriés, nommés et identifiés en fonction des gènes qu'ils expriment (...)
À ce point ?! Pour C Elegans, ok, mais je ne savais pas qu’on en était là pour la drosophile.
11 De Saxifrage Clayborne - 10/01/2011, 21:51
Merci pour toutes ces précisions, et pour cet article très intéressant.
12 De alain Prunier - 11/01/2011, 20:39
Et bien là, on est foutu !
Marine le pen va pouvoir activer les neurones de vote pour elle. Merci les chercheurs.
13 De Sirtin - 12/01/2011, 11:30
Intéressant mais je sens que ça va raviver le débat "expérimentation animale".
:)
14 De Anonymous blog - 23/01/2016, 09:29
#psPlaisir – Pierre Kerner : le plaisir trouble des
(…)